一級(jí)消防工程師消防安全技術(shù)實(shí)務(wù)知識(shí)點(diǎn):燃燒過(guò)程
燃燒過(guò)程
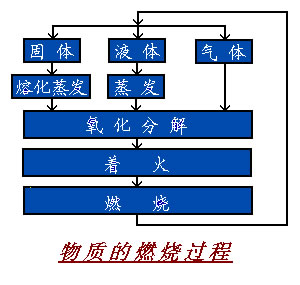
可燃物質(zhì)的燃燒一般是在氣相進(jìn)行的。由于可燃物質(zhì)的狀態(tài)不同,其燃燒過(guò)程也不相同。氣體最易燃燒,燃燒所需要的熱量只用于本身的氧化分解,并使其達(dá)到著火點(diǎn)。氣體在極短的時(shí)間內(nèi)就能全部燃盡。
液體在火源作用下,先蒸發(fā)成蒸氣,而后氧化分解進(jìn)行燃燒。與氣體燃燒相比,液體燃燒多消耗液體變?yōu)檎魵獾恼舭l(fā)熱。固體燃燒有兩種情況:對(duì)于硫、磷等簡(jiǎn)單物質(zhì),受熱時(shí)首先熔化,而后蒸發(fā)為蒸氣進(jìn)行燃燒,無(wú)分解過(guò)程;對(duì)于復(fù)合物質(zhì),受熱時(shí)首先分解成其組成部分,生成氣態(tài)和液態(tài)產(chǎn)物,而后氣態(tài)產(chǎn)物和液態(tài)產(chǎn)物蒸氣著火燃燒。
固體燃燒有兩種情況:對(duì)于硫、磷等簡(jiǎn)單物質(zhì),受熱時(shí)首先熔化,而后蒸發(fā)為蒸氣進(jìn)行燃燒,無(wú)分解過(guò)程;對(duì)于復(fù)合物質(zhì),受熱時(shí)首先分解成其組成部分,生成氣態(tài)和液態(tài)產(chǎn)物,而后氣態(tài)產(chǎn)物和液態(tài)產(chǎn)物蒸氣著火燃燒。
物質(zhì)燃燒時(shí)的溫度變化
T初為可燃物開(kāi)始加熱時(shí)的溫度。最初一段時(shí)間,加熱的大部分熱量用于熔化或分解,可燃物溫度上升較緩慢,到T氧(氧化開(kāi)始溫度)時(shí),可燃物開(kāi)始氧化。由于溫度尚低,故氧化速度不快,氧化所產(chǎn)生的熱量,還不足以克服系統(tǒng)向外界所放熱量,如果此時(shí)停止加熱,仍不能引起燃燒。如繼續(xù)加熱,則溫度上升很快,到T自氧化產(chǎn)生的熱量和系統(tǒng)向外界散失的熱量相等。若溫度再稍升高,超過(guò)這種平衡狀態(tài),即使停止加熱,溫度亦能自行上升,到T′自出現(xiàn)火焰而燃燒起來(lái)。T自為理論上的自燃點(diǎn),T′自為開(kāi)始出現(xiàn)火焰的溫度,即通常測(cè)得的自燃點(diǎn)。T自到T′自這一段延滯時(shí)間稱為誘導(dǎo)期。
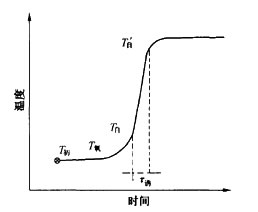
誘導(dǎo)期在安全上有實(shí)用價(jià)值。在可燃?xì)怏w存在的車(chē)間中使用的防爆照明,當(dāng)燈罩破裂或密封性喪失時(shí),即使能自動(dòng)切斷電路熄滅,但灼熱的燈絲自3000℃冷到室溫還需要一定的時(shí)間,爆炸的可能性取決于可燃?xì)怏w的誘導(dǎo)期。對(duì)于誘導(dǎo)期較長(zhǎng)的甲烷或汽油蒸氣(數(shù)秒),普通燈絲不致有危險(xiǎn),但對(duì)于誘導(dǎo)期很短的氫(0.01秒)就需要尋求冷卻得特別快的特殊材料作燈絲,才能保證安全。
燃燒的活化能理論
燃燒是化學(xué)反應(yīng),而分子間發(fā)生化學(xué)反應(yīng)的必要條件是互相碰撞。但并不是所有碰撞的分子都能發(fā)生化學(xué)反應(yīng),只有少數(shù)具有一定能量的分子互相碰撞才會(huì)發(fā)生反應(yīng)。這少數(shù)分子稱為活化分子。活化分子的能量要比分子平均能量超出一定值。這超出分子平均能量的定值稱為活化能。活化分子碰撞發(fā)生化學(xué)反應(yīng),故稱為有效碰撞。
當(dāng)明火接觸可燃物質(zhì)時(shí),部分分子獲得能量成為活化分子,有效碰撞次數(shù)增加而發(fā)生燃燒反應(yīng)。例如,氧原子與氫反應(yīng)的活化能為25.10kJ•mol-1,在27℃、0.1MPa時(shí),有效碰撞僅為碰撞總數(shù)的十萬(wàn)分之一,不會(huì)引發(fā)燃燒反應(yīng)。而當(dāng)明火接觸時(shí),活化分子增多,有效碰撞次數(shù)大大增加而發(fā)生燃燒反應(yīng)。
燃燒的過(guò)氧化物理論
在燃燒反應(yīng)中,氧首先在熱能作用下被活化而形成過(guò)氧鍵—O—O—,可燃物質(zhì)與過(guò)氧鍵加和成為過(guò)氧化物。過(guò)氧化物不穩(wěn)定,在受熱、撞擊、摩擦等條件下,容易分解甚至燃燒或爆炸。過(guò)氧化物是強(qiáng)氧化劑,不僅能氧化可形成過(guò)氧化物的物質(zhì),也能氧化其他較難氧化的物質(zhì)。如氫和氧的燃燒反應(yīng),首先生成過(guò)氧化氫,而后過(guò)氧化氫與氫反應(yīng)生成水。反應(yīng)式如下:
H2+O2→H2O2 H2O2+H2→2H2O
有機(jī)過(guò)氧化物可視為過(guò)氧化氫的衍生物,即過(guò)氧化氫H—O—O—H中的一個(gè)或兩個(gè)氫原子被烷基所取代。所以過(guò)氧化物是可燃物質(zhì)被氧化的最初產(chǎn)物,是不穩(wěn)定的化合物,極易燃燒或爆炸。如蒸餾乙醚的殘?jiān)谐S捎谛纬蛇^(guò)氧乙醚而引起自燃或爆炸。
燃燒的連鎖反應(yīng)理論
在燃燒反應(yīng)中,氣體分子間互相作用,往往不是兩個(gè)分子直接反應(yīng)生成最后產(chǎn)物,而是活性分子自由基與分子間的作用。活性分子自由基與另一個(gè)分子作用產(chǎn)生新的自由基,新自由基又迅速參加反應(yīng),如此延續(xù)下去形成一系列連鎖反應(yīng)。連鎖反應(yīng)通常分為直鏈反應(yīng)和支鏈反應(yīng)兩種類(lèi)型。
直鏈反應(yīng)的特點(diǎn)是,自由基與價(jià)飽和的分子反應(yīng)時(shí)活化能很低,反應(yīng)后僅生成一個(gè)新的自由基。氯和氫的反應(yīng)是典型的直鏈反應(yīng)。在氯和氫的反應(yīng)中,只要引入一個(gè)光子,便能生成上萬(wàn)個(gè)氯化氫分子,這正是由于連鎖反應(yīng)的結(jié)果。