執業藥師《藥學專業知識一》共11章49個章節,分別是:藥物與藥學專業知識、生物藥劑學、藥效學、藥品質量與藥品標準等,涉及的知識廣泛,考核比較細。如果考生學習時間較短,可以利用小編整理的《藥學專業知識一》精講考點匯總,進行短時速記,直擊重點。以下為藥學一第一章高概率必考點,希望大家要認真記憶!>>講師解密核心考點+零風險過關<<
第一章 藥物與藥學專業知識
精講考點:影響藥物制劑穩定性的因素
一、外界因素
| 溫度 | Arrhenius方程描述了溫度與反應速度之間的定量關系,即隨著溫度升高反應速度常數增大。它是藥物穩定性預測的主要理論依據。 |
| 光線 | 光可以引發鏈反應(氧化反應)。常見的對光敏感的藥物有:硝普鈉、氯丙嗪、異丙嗪、核黃素、氫化可的松潑尼松、葉酸、維生素A、維生素B、輔酶Q10、硝苯吡啶等。 |
| 空氣(氧) | 大氣中的氧是引起藥物氧化變質的重要因素。 |
| 金屬離子 | 微量金屬離子對自氧化反應有明顯的催化作用 |
| 濕度和水分 | 空氣濕度與物料含水量對固體藥物制劑的穩定性有較大影響。無論是水解反應,還是氧化反應,微量的水均能加速阿司匹林、青霉素G鈉鹽、氨芐青霉素鈉、對氨基水楊酸鈉、硫酸亞鐵等的分解。藥物是否容易吸濕,取決于其臨界相對濕度(CRH)的大小。一般水分含量在1%左右比較穩定,水分含量越高分解越快。 |
| 包裝材料 | 藥物貯藏于室溫環境中,主要受熱、光、濕度及空氣(氧)的影響。包裝材料與制劑穩定性的關系十分密切,特別是直接接觸藥品的包裝材料。 |
二、處方因素
| pH的影響(液體制劑) | ①藥物的水解受H+或0H-催化,故應通過試驗確定最穩定pHm。 ②受H+或OH-催化水解,這種催化作用也叫專屬酸堿催化或特殊酸堿催化 |
| 廣義酸堿催化 | ①給出質子的物質叫廣義的酸,接受質子的物質叫廣義的堿。有些藥物也可被廣義的酸堿催化水解,這種催化作用叫廣義的酸堿催化或一般酸堿催化。許多藥物處方中,往往需要加入緩沖劑。 ②常用的緩沖劑如醋酸鹽、磷酸鹽、枸櫞酸鹽、硼酸鹽等,均為廣義的酸堿。 |
| 溶劑的影響 | 溶劑的介電常數對離子與帶電荷的藥物間反應的影響可用下式表示: 根據公式 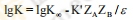 K為速度常數,ε為介電常數,K∞為溶劑ε趨向∞時的速度常數,ZAZB為離子或藥物所帶的電荷。 當ZAZB>0:藥物離子與進攻離子的電荷相同,采用則1gK對1/ε作圖所得的直線為負值,采用介電常數低的溶劑將降低藥物的分解速度。苯巴比妥鈉注射液用于介電常數低的溶劑,例如丙二醇(60%)可使注射液穩定性提高。 當ZAZB<0:藥物離子與進攻離子的電荷相反,如專屬堿催化帶正電荷的藥物,采取ε低的溶劑也無法提高。 |
| 離子強度影響(催化反應) | 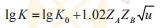 式中,K為降解速度常數;K0為溶液無限稀(μ=0)時的速度常數,μ為離子強度;ZAZB為溶液中藥物所帶的電荷。 當ZA、ZB>0(荷電相同)時,斜率為正值,降解速度隨u的增大而增大; 當ZA、ZB<0(荷電相反)時,斜率為復值,μ增加,降解速度降低; 當ZA、ZB=0(中性藥物)時,斜率為0,離子強度與降解速度無關。 |
| 表面活性劑影響:使穩定性增加(苯佐卡因加十二烷基硫酸鈉);穩定性降低(聚山梨酯80使維生素D穩定性下降) | |
| 處方中基質或賦形劑的影響 | |
備考推薦:2019年執業藥師《藥學一》考點輔導資料| 藥學口訣下載


