2019下半年高中化學教師資格證面試真題及答案第四批
高中化學《電解質(zhì)》
一、考題回顧


二、考題解析
【教學過程】
環(huán)節(jié)一:實驗導入
【展示實驗】播放氯化鈉、鹽酸及酒精水溶液導電的實驗,讓學生觀察現(xiàn)象。
【學生回答】氯化鈉水溶液和鹽酸都可以導電,而酒精的水溶液不能導電。
【提出問題】為什么會出現(xiàn)這種現(xiàn)象呢?其實這節(jié)課就來探究“電解質(zhì)”。
環(huán)節(jié)二:探究新知
【提出問題】NaCl、NaOH和HCl等物質(zhì)溶于水后、在水分子的作用下產(chǎn)生能夠自由移動的水合離子,或者把NaCl、NaOH等固體加熱至熔融,它們會產(chǎn)生自由移動的離子,那么共同特點是什么?
【學生回答】都可以導電。
【教師講解】在水溶液或者熔融狀態(tài)下能導電的化合物叫做電解質(zhì)。
【提出問題】常見的電解質(zhì)有哪些?
【學生回答】常見的酸、堿、大多鹽。
【教師講解】電解質(zhì)在水溶液中或融融狀態(tài)下產(chǎn)生自由移動的例子的過程稱為電離。電解質(zhì)的電離通常用電離方程式表示。電解質(zhì)溶于水后生成水合離子,但為了書寫方便,常寫成簡單離子的形式。
【提出問題】那硫酸、氫氧化鈉和氯化鈉的電離方程式如何書寫?
【學生回答】H2SO4=2H++SO42-,NaOH=Na++OH-,NaCl=Na++Cl-
【提出問題】結合電離方程式發(fā)現(xiàn)了什么?
【學生回答】 HCl、H2SO4等酸在水溶液中都能電離出H+,而且溶液中所有的陽離子都是H+。NaOH、Ca(OH)2等堿在水溶液中都能電離出OH-,而且在溶液中所有的陰離子都是OH-。NaCl、(NH4)SO4等鹽溶液中可電離出金屬陽離子(或銨根離子)和酸根離子。
【提出問題】從電離的角度如何理解酸、堿?
【學生回答】從電離的角度看,酸是電離時生成的陽離子全部是H+的化合物。堿是電離時生成的陰離子全部是OH-的化合物。
【教師講解】蔗糖、酒精等化合物,無論在水溶液還是熔融狀態(tài)下均以分子形式存在,因而不能導電,這樣的化合物叫做非電解質(zhì)。
【提出問題】常見的非電解質(zhì)有哪些?
【學生回答】葡萄糖、淀粉、油脂等有機化合物大多數(shù)是非電解質(zhì)。
【提出問題】如何去區(qū)分電解質(zhì)和非電解質(zhì)?
【學生回答】看是否能夠在水溶液或者熔融狀態(tài)下導電。
環(huán)節(jié)三:拓展提升
【提出問題】下列說法錯誤的是( )
A.能夠?qū)щ姷幕衔镆欢ㄊ请娊赓|(zhì)
B.電解質(zhì)是指在水溶液或者熔融狀態(tài)下能夠?qū)щ姷幕衔?/p>
C.酸、堿、鹽屬于電解質(zhì)
D.電解質(zhì)在水溶液中存在的形式有分子和離子
【學生回答】A。能夠?qū)щ姷幕衔锊灰欢ㄊ请娊赓|(zhì),如金屬中的鋁和銅也能夠?qū)щ姡遣粚儆陔娊赓|(zhì)。
環(huán)節(jié)四:小結作業(yè)
學生總結歸納本節(jié)課所學主要知識,表述學習心得。
作業(yè):查找資料了解電解質(zhì)的分類。
板書設計略
高中化學《明礬的凈水作用》
一、考題回顧

二、考題解析
【教學過程】
環(huán)節(jié)一:實驗導入
【教師演示】教師演示明礬凈水的實驗:取適量研磨細的明礬粉末加入到盛有河水的一個燒杯中攪拌,觀察現(xiàn)象。

【學生回答】加入了明礬的水變得澄清了。
【教師引導】這種白色物質(zhì)明礬是什么?它是如何起到凈化水的作用呢?這節(jié)課我們就一起來探究“明礬的凈水作用”。
環(huán)節(jié)二:探究新知
【教師講解】明礬是一種無色的晶體,易溶于水。化學式:KAl(SO4)2·12H2O。
【提出問題】通過明礬的化學式,說明明礬由哪些粒子構成?
【學生回答】K+、Al3+、SO42—,晶體中還結合有水分子(H2O)。
【教師引導】明礬中含有兩種陽離子:鉀離子和鋁離子,一種陰離子:硫酸根離子,像明礬這樣的鹽屬于復鹽。
【教師提問】你能嘗試描述復鹽的定義嗎?
【學生回答】復鹽是由兩種或兩種以上陽離子和一種陰離子組成的鹽。
【媒體展示】提出問題:判斷以下四種物質(zhì)中屬于復鹽的是哪一種?
①硫酸亞鐵銨:(NH4)2Fe(SO4)2·6H2O
②偏鋁酸鈉:NaAlO2
③硫酸鐵鉀:KFe(SO4)2·12H2O
④堿式碳酸銅:Cu2(OH)2CO3
【學生回答】學生1.③;學生2.①③;學生3.②③等等。
【教師總結引導】屬于復鹽的是①③
①硫酸亞鐵銨俗名為莫爾鹽,含有兩種陽離子:銨根離子和亞鐵離子,一種陰離子硫酸根離子,所以屬于復鹽;
②偏鋁酸鈉是由陽離子鈉離子和陰離子偏鋁酸根離子構成的,只有一種陽離子鈉離子,鋁元素是以偏鋁酸根的形式存在于陰離子中,不屬于復鹽;
③硫酸鐵鉀中含有兩種陽離子:鉀離子和鐵離子,一種陰離子硫酸根離子,屬于復鹽;
④堿式碳酸銅只含有一種陽離子銅離子,兩種陰離子,不屬于復鹽。
【提出問題】結合復鹽的概念,書寫明礬溶于水發(fā)生電離的方程式,其他學生在紙上書寫。
【學生板書】KAl(SO4)2=K++Al3++2SO42-
【教師引導】明礬是一種常見的凈水劑,之前我們在學習膠體的時候有了解一種具有凈水作用的物質(zhì)——氫氧化鐵[Fe(OH)3]膠體。
【提出問題】氫氧化鐵膠體是如何起到凈水作用的?利用了膠體的哪種性質(zhì)?
【學生回答】利用了膠體的吸附性,氫氧化鐵膠體通過吸附水中的懸浮顆粒,沉降后達到凈水目的。
【教師引導】明礬凈水的實質(zhì)與氫氧化鐵膠體凈水實質(zhì)是相同的。嘗試推斷明礬凈水的實質(zhì)和原理是什么?
【合作探究】明礬溶于水后電離出的鋁離子進一步與水反應,即鋁離子發(fā)生水解,生成了氫氧化鋁[Al(OH)3]膠體,Al(OH)3膠體具有很強的吸附能力,它能凝聚水中的懸浮物并使之沉降,從而達到凈水的目的。
【媒體展示】多媒體播放視頻:150倍速下,河水中的懸浮物在Al(OH)3膠體作用下的沉降過程,學生直觀感受、加深認知。

【教師引導】注意膠體不是沉淀,不能在Al(OH)3后面寫沉淀符號“↓”。
環(huán)節(jié)三:拓展提升
【教師引導】已知明礬的凈水原理,可以利用這些知識解決日常生活中的很多問題。接下來分小組討論如下兩個問題:
①明礬凈水的實質(zhì)是什么?
②明礬作為凈水劑,能夠?qū)λM行殺菌消毒嗎?
【小組討論,教師總結】
①明礬凈水的實質(zhì)是氫氧化鋁膠體的吸附性。
②明礬不具有強氧化性,所以只能凈化水但不能對水起到殺菌消毒的作用。
環(huán)節(jié)四:小結作業(yè)
請學生暢談收獲,體會收獲與成功的喜悅。
作業(yè):課下查閱資料,生活中還有哪些凈水劑、其凈水的原理是什么。
板書設計略
高中化學《離子反應及其發(fā)生的條件》
一、考題回顧
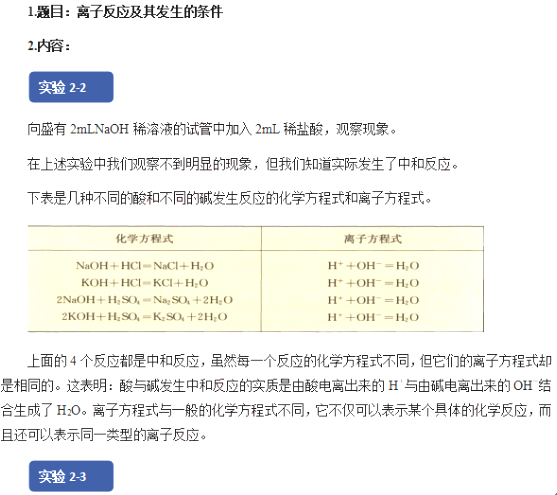
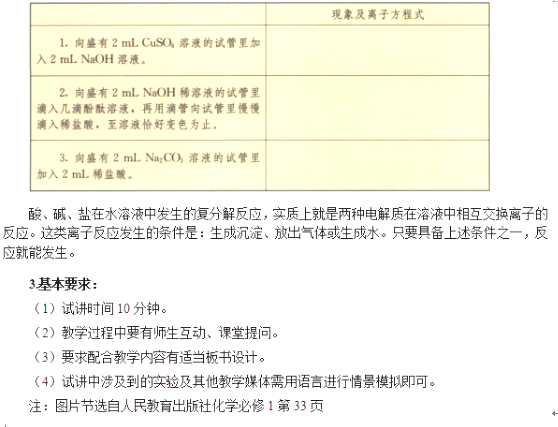
二、考題解析
【教學過程】
環(huán)節(jié)一:生活導入
【提出問題】根據(jù)我們上節(jié)課的學習,離子方程式如何書寫?
【學生回答】“寫、拆、刪、查”。
【提出問題】哪些條件下可以發(fā)生離子反應?
【學生回答】在生成難溶物時可以發(fā)生,例如Na2SO4與BaCl2反應生成BaSO4沉淀。
【教師引導】今天我們就來探究還有哪些條件可以發(fā)生離子反應。
環(huán)節(jié)二:探究新知
【提出問題】根據(jù)之前所學及預習,猜想有哪些條件可以發(fā)生離子反應?
【學生回答】除難溶物之外還有水、氣體參與反應或生成的條件下可發(fā)生離子反應。。
【教師引導】那今天我們就通過兩組實驗來探究有水、氣體參與反應或生成的條件下是否能發(fā)生離子反應?
實驗1:向盛有2mLNaOH溶液的試管中先滴加兩滴酚酞,再滴加稀HCl,觀察現(xiàn)象并思考原因?
【學生回答】溶液由紅色變?yōu)闊o色,NaOH與HCl發(fā)生了離子反應生成了水。
【教師總結】NaOH電離出Na+和OH-,OH-使溶液顯堿性,滴加酚酞指示劑后變紅,滴加稀鹽酸OH-和H+發(fā)生中和反應,即H++OH-=H2O,溶液又褪色,OH-和H+數(shù)目減少,Na+和C1-數(shù)目沒有發(fā)生變化。說明在有水生成的條件下可以發(fā)生離子反應,離子反應式為:H++OH-=H2O。
【教師引導】我們通過實驗已經(jīng)證明了在有難溶物、水參與的條件下可以發(fā)生離子反應,有氣體參與的反應又該如何驗證呢?
【學生回答】用Na2CO3和HCl反應生成CO2來驗證。
【學生操作】實驗2:向盛有2mLNa2CO3溶液的試管中加入2mLHCl溶液。
【描述現(xiàn)象】溶液中有氣泡產(chǎn)生,發(fā)生了離子反應。
【教師總結】Na2CO3電離出Na+和CO32-,滴加稀鹽酸后CO32-和H+反應生成H2O和CO2,即
CO32-+H+=H2O+CO2↑,CO32-和H+數(shù)目減少,Na+和Cl-數(shù)目沒有發(fā)生變化。
【教師總結】酸、堿、鹽在水溶液中發(fā)生的復分解反應,實質(zhì)上就是兩種電解質(zhì)在溶液中相互交換離子的反應。這類離子反應發(fā)生的條件是:生成沉淀、放出氣體或生成水。只要具備上述條件之一,反應就能發(fā)生。
環(huán)節(jié)三:拓展提升
【媒體展示】已知離子反應發(fā)生的條件是:生成沉淀、放出氣體或生成水,那接下來大家來判斷多媒體上的著幾組物質(zhì)能否發(fā)生離子反應?(PPT)。
【學生回答】1.NaOH與H2SO4(可以)
2.NaCl與H2SO4(不可以)
3.AgNO3與NaCl(可以)
(四)小結作業(yè)
學生總結歸納本節(jié)課所學主要知識,表述學習心得。
作業(yè):課下總結酸、堿、鹽發(fā)生的離子反應方程式。
板書設計略
下載233網(wǎng)校APP,可方便及時獲取高中化學教師資格證面試真題。

真題推薦:歷年教師資格證面試真題>>>
教師資格證面試如何快速通關?233網(wǎng)校還原面試情景現(xiàn)場,助你一舉攻下“結構化面試+試講+答辯”三大內(nèi)容,實戰(zhàn)通關!試聽課程>>
答疑解惑:添加小編微信個人號【ks233wx3】,或關注微信公眾號【jiaoshi_233】搜索微信公眾號“233網(wǎng)校教師資格證考試”,關注即可一對一答疑解惑!

