【2021上半年教資面試真題及答案匯總>>】【在線真題庫>>】
2021上半年高中化學教師資格證面試考試已結束,233網校更新了本次考試真題及答案,供各位考生參考!

1題目:二氧化硅
2.內容:
SiO2是硅最重要的化合物。地球上存在的天然二氧化硅約占地殼質里的12%,其存在形態有結晶形和無定形兩大類,統稱硅石。
石英晶體是結晶的1氧化硅 ,具有不同的晶型和色彩 。石英中無色透明的晶體就是通常所說的水晶,具有色彩環帶狀或層狀的稱為瑪瑙。沙子中含有小粒的石英晶體。
SiO2的網狀結構決定了它具有優良的物理和化學性質,加上SiO2在自然界的廣泛存在,從古到今都被人類廣泛地應用著。例如,以SiO2為主要成分的沙子仍然是基本的建筑材料,純凈的SiO2是現代光學及光纖制品的基本原料,用石英、瑪瑙制作的飾物和工藝品則為越來越多的人們所喜愛。
思考交流
根據SiO2的存在和應用;請你分析以下問題: SiO2具有哪些物理性質?化學穩定性如何?你的根據是什么? SiO2的這些性質是由什么決定的?將你的認識寫在下面橫線上,并與同學交流。
物理性質:
化學穩定性:
SiO2的化學性質很不活潑,氫氟酸(HF) 是惟一可以與之發生反應的酸:
SiO2+4HF- =SF4↑+2H2O
玻璃中含有SiO2,所以可以用HF來刻蝕玻璃。
SiO2是酸性氧化物,它可能發生哪些化學反應? SiO2與堿性氧化物反應生成鹽,例如:
SiO:+CaO====CaSiO3
SiO2與強堿反應生成鹽,例如:
SiO2+2N2OH====Na2SiO3+H2O
3基本要求:
(1)試講時間10分鐘。
(2)教學過程中要有師生互動、課堂提問。
(3)要求配合教學內容有適當板書設計。
參考解析:
[教學過程]
一:情景引入
教師提問:同學們,大家知道我們日常生活中見到的巖石和沙子屬于什么狀態的物質嗎?主要成分是什么?
學生回答:巖石和沙子是固態的物質,硬度很大。
教師總結:對,巖石和沙子非常堅硬,因為它的主要成分是二氧化硅,這節課就一起來探究“二氧化硅”的性質。
二:新課教學
[復習回顧]二氧化硅與二氧化碳都是IVA族元素形成的最高價氧化物,它們的性質是否相同呢?回憶初中學過的二氧化碳的性質,并從物理性質和化學性質兩方面回答。
學生回答:①二氧化碳的物理性質:常溫常壓下是無色無味的氣體,能溶于水,密度比空氣大;
②能與水反應生成碳酸,能與堿反應,是酸性氧化物。
[媒體展示]觀看視頻上展示的多種含二氧化硅的物質,比較二氧化碳和二氧化硅的物理性質。
學生回答:二氧化硅與二氧化碳的物理性質差別很大,它是一-種堅硬難熔的固體,不溶于水。
教師提問:二氧化硅有哪些應用?
學生回答:①以SiO2為主要成分的沙子是基本的建筑材料;
②用石英、瑪瑙可以制作各種飾物和工藝品。
[教師補充]純凈的SiO2是現在光學及光纖制品的基本原料。
[視頻展示]二氧化硅和-氧化碳都是酸性氧化物,那么它們的化學性質是否相同呢,觀看視頻演示的二氧化硅分別與鹽酸、硫酸、氫氟酸反應的視頻,描述現象,并書寫化學方程式?
學生回答:二氧化硅與鹽酸、硫酸不反應,與氫氟酸能夠發生反應,
SiO2+4HF==SiF4↑+2H2O。
[教師講解]與CO2不同,SiO2的化學性質很不活潑,氫氟酸是惟一可以與之發生反應的酸。SiO2 可以與堿性氧化物、堿反應,類比二氧化碳的方程式書寫方法,嘗試寫出SiO2與氧化鈣、氫氧化鈉反應的化學方程式。
[學生回答] SiO2+CaO===CaSiO3、SiO+2NaOH== Na2SiO3+H2O。
三:拓展提高
[教師引導]己知二氧化硅的物理性質和化學性質,可以利用這些知識解決日常生活中的很多問題。接下來分小組討論如下兩個問題:
①為什么實驗室中盛放堿液的試劑瓶用橡皮塞而不用玻璃塞?
②氫氟酸能否儲存在玻璃試劑瓶中,你有什么啟示?
[合作探究]
①因為玻璃中含有SiO2, SiO2 是酸性氧化物,能和堿起反應,容易使玻璃瓶塞和瓶頸粘在一起而不能打開。
②二氧化硅與氫氟酸能夠發生反應,故不能用玻璃試劑瓶盛裝氫氟酸,可以用塑料制品或鉛器皿儲存,我們可以用氫氟酸雕刻玻璃。
四:小結作業
小結:這節課我們學習了二氧化硅及其物理性質和化學性質,了解了二氧化硅是一種及其堅硬的固體,不溶于水,希望同學們能夠將課堂所學應用到今后的學習和生活中。
作業:思考元素的金屬性和非金屬性的遞變規律如何?
板書設計:略
1.題目:高一《硅的性質》片段教學
2.內容:硅的性質
3.基本要求:
(1)試講約10分鐘;
(2)試講過程中注意對于學生的引導;
(3)配合教學內容適當板書。
一、問題導入,激發情感
1.教師展示新興職業,提問:同學們對哪些新興職業更感興趣呢?
2.教師提出問題:你知道計算機中最重要的是什么嗎?今天我們就來學習一下計算機中芯片中的重要元素一硅。
二、自主探究,講授新課
1.教師提出問題,請同學們從元素周期律的角度來推測一下硅單質有哪些性質?
2.學生根據硅元素在元素周期表中的位置關系,推測出硅為過渡元素,可以初步推測硅單質的相關性質。
3.教師展示硅單質,請學生觀察并總結硅單質的相關的物理性質,教師對學生的總結進行補充,完善硅單質的物理性質。
4.教師請學生通過閱讀資料的方式了解硅在自然界中的存在方式及用途。
5.教師提出問題,如何將自然界中的二氧化硅轉化為可利用的高純硅呢?學生分組合作并進行合理猜測。
6.教師請學生觀看高純硅的制備視頻,并請學生結合資料卡片,組內討論硅的制取原理。北同現心
7.學生通過視頻,組內討論得出二氧化硅轉化為單質硅的原理。
8.教師播放硅單質的應用視頻,請學生總結單質硅的用途。
三、習題拓展,鞏固新知
通過多媒體的展示習題,將學生本節課學習到的知識進行深化。
四、歸納總結,深入理解
由學生總結本堂課的收獲,教師對學生的課堂表現予以肯定,并做情感態度的升華。
五、緊扣主題,擴展延伸
請學生課下查閱資料,以“你不了解的硅”為主題,寫一篇科普文章。
六、板書設計:略
1.題目:高一《鹵素單質與氫氣反應》片段教學
2:內容:

3.基本要求:
試講約10分鐘;
(2)試講過程中注意對于學生的引導;
(3)配合教學內容適當板書。
一、問題導入,激發情感
1.教師出示多瓶不同顏色的氣體,請同學們利用所學知識猜測是哪些氣體?
2.學生利用鹵素單質的性質這一知識點,快速判斷出氣體。
3.教師提出問題:鹵素單質有哪些化學性質呢?引入課題。
二、實驗探究,講授新課
1.教師請學生從氧化還原的角度推測鹵素單質的性質。學生初步預測鹵素單質的性質。
2.教師對學生的預測進行點評,并介紹鹵素單質可以與氫氣反應這一特性。師
3.教師請學生從原子結構的角度推測不同鹵素單質與鹵素單質反應的難易程度。
4.教師請學生觀察鹵素單質與氫氣反應的實驗視頻,請學生根據視頻判斷自己的預測是否準確。
5.學生總結鹵素單質與氫氣反應過程中的現象,并用表格的形式進行匯總。教師進一步提出問題:請回憶鹵素單質與氫氣的反應,嘗試總結生成的氫化物的穩定性。
6.學生通過對視頻的回顧,組內討論, 總結出生成氫化物的穩定性。
7.教師請學生對上述反應進行分析,總結出鹵素單質非金屬性的強弱變化。
8.教師提出問題:請同學們觀察以上的遞變性,嘗試總結鹵素單質與氫氣反應中的遞變性。
三、習題拓展,鞏固新知
通過多媒體的展示習題,將學生本節課學習到的知識進行深
四、歸納總結,深入理解
由學生總結本堂課的收獲,教師對學生的課堂表現予以肯定,并做情感態度的升華。
五、緊扣主題,擴展延伸
請學生課下查閱資料,了解鹵素單質之間的反應。
板書設計:略
1題目,高一《鐵的氧化物》片段教學
2.內容:

3.基本要求
(1)試講約10分鐘;
(2)試講過程中注意對于學生的引導;
(3)配合教學內容適當板書。
一、問題導入,激發情感
1教師展示我國金屬使用分布圖,提出問題:我國使用最多的金屬是什么呢?我國金屬浪費最多的是哪種金屬呢?
2.學生通過對圖片的觀察得出使用最多的金屬是鐵,同時通過日常生活中金屬的浪費現象得出浪費最嚴重的的金屬是鐵。
3.教師提出問題:鐵的浪費大部分是由于氧化,鐵有哪些氧化物呢?
二、實驗探究,講授新課
1.教師請學生根據鐵元素的化合價猜測鐵的氧化物的種類。
2.教師展示氧化鐵,氧化亞鐵,四氧化三鐵。請學生觀察鐵的三種氧化物的物理性質,并分析對應氧化物中鐵的化合價。
3.教師補充介紹鐵的三種氧化物物理性質并介紹其在日常生活中的應用。
4:教師請學生通過鐵的氧化物的物理性質總結三種氧化物的鑒別方式。學生總結出可以通過顏色及氧化性對三種氧化物進行鑒別。
5.教師請學生預測鐵的氧化物的化學性質。學生根據金屬氧化物與酸反應的特性,推斷三種物質都能與酸反應。
6.教師請學生進行分組實驗,驗證鐵的氧化物與鹽酸反應的反應原理。
7.學生動手實驗,并總結實驗現象及反應原理。
8.教師請學生以表格的形式匯總鐵的氧化物的物理性質與化學性質。
三、習題拓展,鞏固新知
通過多媒體的展示習題,將學生本節課學習到的知識進行深化。
四、歸納總結,深入理解國教師
由學生總結本堂課的收獲,教師對學生的課堂表現予以肯定,并做情感態度的升華。
五、緊扣主題,擴展延伸
請學生課下查閱資料,了解鐵相關合金的知識。
板書設計:略
1.題目: 高中《氯氣與水反應》片段教學
2.內容:

3.基本要求:
(1)試講約10分鐘;
(2)試講過程中注意對于學生的引導;
(3)配合教學內容適當板書。
一。多媒體導入,激發情感
1.多媒體播放凈水廠用氯氣對自來水進行殺菌消毒的視頻,提出問題:氯氣凈水的原理是哪些呢?
二、實驗探究,講授新課
1.教師展示氯氣溶于水的資料卡片,提出問題:氯氣的溶解度如何?學生總結出1體積水可溶解約2體積的氯氣。
2.教師演示氯氣溶于水的實驗,并介紹氯水溶于水之后形成的溶液為氯水。
3.教師提出問題:氯水有哪些性質呢?請學生進行猜測。
4.學生預測氯水顯酸性,猜測氯氣與水反應形成鹽酸。教師請學生從化合價的角度分析,預測可能會生成次氯酸。教師對學生的預測進行肯定。
5.教師進- -步提出問題:為什么是氯氣溶于水可以殺菌消毒呢?
6.學生通過分析總結出可能是由于次氯酸具有氧化性,可以殺菌消毒。
7.教師介紹國家對于氯氣凈水的相關規定。
三、習題拓展,鞏固新知
通過多媒體的展示習題,將學生本節課學習到的知識進行深化。
四、歸納總結,深入理解
由學生總結本堂課的收獲,教師對學生的課堂表現予以肯定,并做情感態度的升華。
五、緊扣主題,擴展延伸
請學生課下查閱資料,了解次氯酸的其他應用。
板書設計:
氯氣與水反應
1.Cl2+H2O=HCI+HCIO
2.次氯酸具有氧化性,可以殺菌消毒
1.題目:高一《膠體的丁達爾效應》片段教學
2.內容:

3.基本要求:
(1).試講約10分鐘;
(2)試講過程中注意對于學生的引導;
(3)配合教學內容適當板書。
一、問題導入,激發情感
1.教師提出問題:同學們我們生活中常見的膠體有哪些呢?學生梳理常見的膠體并回答問題。
2.教師展示清晨樹林中的于達爾效應圖片,提出問題:霧是膠體的一種,為什么霧會出現圖片中的現象呢?
二、實驗探究,講授新課
1.教師請同學們分組利用硫酸銅溶液制備氫氧化銅膠體。
2.學生設計膠體制備實驗,并分組進行膠體的制備。教師巡視學生實驗,并對學生的實驗進行點評。
3.教師讓學生利用紅色激光筆在陰暗的環境下照射硫酸銅溶液和氫氧化銅膠體,觀察并記錄實驗現象。
4.教師請學生分別匯報實驗現象,總結出激光筆照射膠體會出現紅色的光亮的“通路”, 溶液不會出現這一結論。
5.教師請學生進一步通過不同的膠體與溶液進一步驗證這一結論。
6.教師介紹于達爾效應。并提出問題:為什么會出現丁達爾效應呢?
7.學生分組討論得出出現于達爾效應的原因可能與膠體粒子的直徑有關。
8.教師播放丁達爾效應的短視頻,請同學們觀看視頻,總結出丁達爾效應的原因是由于膠體粒子對光的散射形成的。
9、教師介紹丁達爾效應的發現史,帶領學生進一步認識認識
10.教師提出問題:如何鑒別溶液與膠體呢?學生總結出丁達.爾效應可以有效地鑒別溶液與膠體。
11.教師提出問題:生活中還有哪些J達爾效應呢?請學生們分組討論并總結。
三、習題拓展,鞏固新知
通過多媒體的展示習題,將學生本節課學習到的知識進行深化。
四、歸納總結,深入理解.
由學生總結本堂課的收獲,教師對學生的課堂表現予以肯定,
并做情感態度的升華。
五、緊扣主題,擴展延伸
請學生課下查閱資料,了解膠體有哪些應用,并書寫一篇科普短文。
板書設計:
飽和溶液
1.膠體的丁達爾效應:膠體粒子對光的散射形成的。
2.溶液與膠體鑒別:丁達爾效應
1.題目:高一《硫酸與硝酸的氧化性》片段教學
2.內容:

3.基本要求:
(1)試講約10分鐘;
(2)試講過程中注意對于學生的引導;
(3)配合教學內容適當板書。
一、問題導入,激發情感
1.教師提出問題:硫酸和硝酸都具有酸的通性,具體有哪些?
2.學生總結酸的通性,教師進一步提出問題:實驗室里用金屬和酸的反應制取氫氣時,往往用稀硫酸或鹽酸,而不用濃硫酸或硝酸,這是為什么?
二、實驗探究,講授新課
1,教師通過播放視頻引導學生回顧濃硫酸的吸水性與脫水性。
2.教師提出問題:在濃硫酸的脫水性實驗中,產生的具有刺激性氣體是什么呢?學生根據元素守恒及二氧化硫的性質,推測生成的氣體為二氧化硫。
3.如果生成的氣體為二氧化硫,體現硫酸的哪些特性呢?學生通過元素化合價的變化,推測濃硫酸可能具有強氧化性。
4.教師演示銅與濃硫酸加熱的反應,請學生觀察實驗現象,
5.學生通過對實驗的觀察總結出濃硫酸具有氧化性,可以與
銅生成二氧化硫,進一步確定濃硫酸具有氧化性的猜測。
6.教師進一步 解釋濃硫酸與蔗糖反應過程中生成二氧化硫的原理。
7,濃硫酸不能和活潑金屬制取氫氣時因為它的強氧化性,硝酸是否具有一樣的性質呢? a 教師
8.學生觀看濃硝酸與稀硝酸分別與銅反應的視頻實驗,組內談論。
9.學生通過討論總結出濃硝酸與稀硝酸都具有氧化性,可以與銅反應生成氮的氧化物。
三、習題拓展,鞏固新知
通過多媒體的展示習題,將學生本節課學習到的知識進行深化。
四、歸納總結,深入理解
由學生總結本堂課的收獲,教師對學生的課堂表現予以肯定,并做情感態度的升華。
五、緊扣主題,擴展延伸
請學生課下查閱資料,了 解濃硫酸與濃硝酸的應用。
板書設計:略
1.題目:高一《元素周期表》片段教學
2.內容:

3.基本要求:
(1)試講約10分鐘;
(2)試講過程中注意對于學生的引導;
(3)配合教學內容適當板書。
一、故事導入,激發情感
1:教師用多媒體出示門捷列夫的圖片,并講述門捷列夫發現元素周期表的故事,引入新課,激發興趣。
二、問題探究,講授新課
1.教師請學生觀察教材中的元素周期表,初步認識元素周期表的結構及其元素。
2,教師提出問題:元素周期表中有多少種元素?結構如何?
3.學生通過對教材的閱讀,發現元素周期表中共112種元素,7橫行,18縱行。
4.教師介紹周期、主族、副族、八族、零族的概念。并請同學們總結元素周期表中的周期數,主族數,副族數等。學生發現元素周期表包含:七個周期,七個主族,七個副族,一個八族,
一個零族。
5.教師進一步引導學生發現周期元素的種類。引導學生發現短周期、長周期和不完全周期。
6.教師請學生分組繪制不同周期中所有元素的核外電子排布,并發現其中的規律。
7.學生通過繪制同周期原子的核外電子排布總結出:周期數=核外電子層數這一-規律。
8.教師引導學生發現主族元素的原子之間的關系,學生總結得出:族序數=最外層電子數這一規律。
9.教師提出問題:元素周期表是如何排列的呢?學生通過對周期關系,族關系的分析得出結論。
三、習題拓展,鞏固新知
通過多媒體的展示習題,將學生本節課學習到的知識進行深化。
四、歸納總結,深入理解
由學生總結本堂課的收獲,教師對學生的課堂表現予以肯定,并做情感態度的升華。
五、緊扣主題,擴展延伸
請學生課下繪制前四周期元素的原子結構示意圖,并嘗試探究他們對化學性質的影響。
板書設計:
元素周期表
元素周期表:七個周期,七個主族,七個副族,-一個八族,一個零族
存在關系
周期數=核外電子層數
族序數=最外層電子數(主族)
1.題目:高一《鐵合金》片段教學
2:內容:

3.基本要求:
(1)試講約10分鐘;
(2)試講過程中注意對于學生的引導;
(3)配合教學內容適當板書。
一、問題導入,激發情感
1.教師提出問題:鐵是我國使用最多的金屬,但是鐵比較活潑,極易氧化為氧化物,如何防止鐵的氧化呢?
2.學生總結防止鐵的氧化的措施包括:刷漆、涂油、電鍍、制作合金等方式。
3:教師提問:對于鐵的合金你了解哪些呢?引入課題。
二、問題探究,講授新課
1.教師提出問題:什么是合金呢?鐵有哪些合金呢?
2.學生通過閱讀教材,總結出合金的概念,以及鐵的合金包括生鐵和鋼。.
3.教師展示生鐵和鋼,并播放生鐵和鋼硬度,脆度,機械性能,延展性等方面的測試視頻。請學生通過表格總結出相關的性能。
4教師播放鋼中碳素鋼的三種類型(低碳鋼、中碳鋼、高碳鋼),并請學生觀察三種鋼的不同應用。
5.學生通過對視頻的觀看,總結出低碳鋼、中碳鋼、高碳鋼的應用,并通過表格的方式進行對比分析。
6.教師介紹合金鋼的組成、性能及相關應用,并請學生通過合金鋼的性能預測合金鋼的應用。
7.教師提出問題:生活中常見的鐵的合金有哪些是呢?學生思考得出不銹鋼也是鐵的合金。
8.教師通過資料卡片的形式介紹不銹鋼的組成及其相關性質等。
9.學生通過不銹鋼的性質,自行推斷出不銹鋼的應用。
三、習題拓展,鞏固新知
通過多媒體的展示習題,將學生本節課學習到的知識進行深化。
四、歸納總結,深入理解
由學生總結本堂課的收獲,教師對學生的課堂表現予以肯定,并做情感態度的升華。
五、緊扣主題,擴展延伸
請學生課下查閱資料,了解不同的合金,及其應用。
板書設計:略
1.題目:高一《蒸餾》片段教學
2.內容:

3.基本要求:
(1)試講約10分鐘;
(2)試講過程中注意對于學生的引導;
(3)配合教學內容適當板書。
一、問題導入,激發情感
1.教師展示一杯無色透明的液體,提出問題:同學們,這杯液體可以飲用嗎?
2.學生通過已有知識得知溶液中可能存在可溶雜質,不能直接飲用。
3.教師進一步提出問題:如何將這杯液體提純呢?引入課題蒸餾
二、實驗探究,講授新課
1.教師提出問題:實驗室我們可以用哪些方法進行分離與提純呢?
2.學生總結出可以通過過濾、蒸發等操作進行提純。
3.教師進一步提出問題:如果溶液為液體與液體的混合?那么可以利用哪些原理進行除雜呢?
4.學生分組討論,得出結論:可以利用液體之間的沸點不同,進行除雜。
5.教師對學生的結論進行表揚,并介紹蒸餾操作的原理與實驗儀器。
6.教師請學生根據實驗裝置,及實驗原理總結實驗過程中的注意事項(溫度計的位置、冷凝管的使用、沸石的使用等)。
7.學生們分組進行蒸餾操作的實驗。實驗過程中教師進行巡視指導。
8.教師總結學生實驗過程中出現的問題。并提出問題:蒸餾有哪些應用呢?
9.學生總結蒸餾的應用,并通過資料卡片的方式了解利用蒸餾進行海水淡化的原理。
三、習題拓展,鞏固新知
通過多媒體的展示習題,將學生本節課學習到的知識進行深化。
四、歸納總結,深入理解
由學生總結本堂課的收獲,教師對學生的課堂表現予以肯定。
五、緊扣主題,擴展延伸
請學生課下將所學過的凈化方式進行對比,總結相關特點。
板書設計:略
1.題目:元素周期律
2.內容:
物質世界盡管豐富多彩、變化無窮,但一切物質都是由元素組成的。人類在長期的生產活動和科學實驗中,逐漸認識了元素間的內在聯系和元素性質變化的規律性,并以一定的方式將它們表示出來。
聯想:質疑
目前已經發現的元素有110多種,在元素周期表中,元素是有序排列的。你是否想過元素為什么會按照這樣的順序在元素周期表中排列?它們之間存在著什么關系?人們是怎樣描述這種關系的?
一、元素周期律
原子序數( atomic number)是元素在元素周期表中的序號,其數值等于原子核內的質子數或原子核外的電子數。研究原子序數為1-18的元素,可以幫助我們認識元素之間的內在聯系和元素性質變化的規律性。
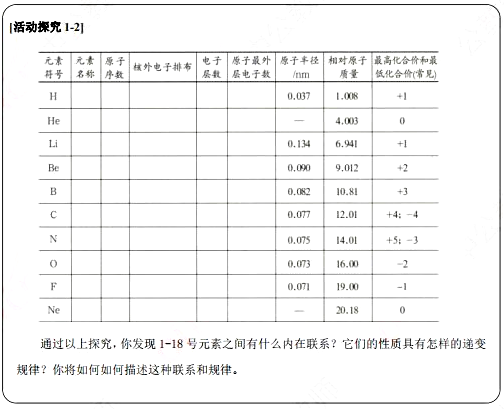
通過探究可以發現:隨著原子序數的遞增,元素原子的最外層電子排布、原子半徑、元素的化合價等均呈現周期性變化。在大量科學研究的基礎上,人們歸納出這樣一條規律:元素的性質隨著元素原子序數的遞增呈周期性變化,這個規律叫做元素周期律.
3.基本要求:
(1)講解元素周期律。
(2)體現探究性。
(3)有適當板書。
一、情景引入
多媒體給同學展示元素周期表的圖片。
教師提問:我們都知道,在元素周期表中,元素是有序排列的。那元素為什么會按照這樣的順序排列?它們之間存在著什么關系?今天我們就一起來研究元素周期表的有關規律。
二、新課教學
提出問題:什么是原子序數?
學生回答:元素在元素周期表中的序號。
教師補充:其數值等于原子核內的質子數或原子核外的電子數。
活動探究:以小組為單位進行活動探究1-2。
教師引導:元素原子的最外層電子排布、原子半徑、元素的化合價等方面進行探究,并探究到前18號元素。
提出問題:通過以上探究,發現元素之間有什么內在聯系?它們的性質具有怎樣的遞變規律?你將如何描述這種聯系和規律?
學生回答:隨著原子序數的遞增,元素原子的最外層電子排布、原子半徑、元素的化合價等均呈現周期性變化。(1) 同一周期元素結構和性質具有一定的遞變性,同周期電子層數不變,從左到右原子半徑逐漸減小。
(2)同一主族元素結構和性質具有一定的相似性和遞變性,同一主族從上到下電子層數依次增加原子半徑逐漸增大。
提出問題:什么是元素周期律?
學生回答:元素的性質隨著元素原子序數的遞增呈周期性變化,這個規律叫做元素周期律。
三、拓展提高
提出問題:原子序號、核電荷數、質子數三者是等同的么?
學生回答:核電荷數和質子數是等同的,但是和原子序號有所區別,原子序號只是數值上與核電荷數、質子數相等,代表的意義不一樣。
四、小結作業
小結:引導學生共同總結本節課的內容。
作業:思考元素的金屬性和非金屬性的遞變規律如何?
五、板書設計:略
面試題庫>>教師資格證面試題庫免費刷(各科目)
考后關注>>2021上半年教師資格證面試成績查詢時間、入口
教師資格證面試如何快速通關?233網校還原面試情景現場,助你一舉攻下“結構化面試+試講+答辯”三大內容,實戰通關!試聽課程>>




